AI制药,一个被称作明星赛道的行业。
不仅融资消息隔三差五传出,更被认为是计算生物最有希望落地的领域。
据量子位智库预测,AI制药行业国内市场保守估计将达到2040亿元规模。
在这样的前景下,不仅国内外高校博士生和教授纷纷投身创业,就连互联网大厂们也争相入资角逐。
如今AI制药步入热度高峰后的瓶颈突破期,各玩家的差异性也逐步显现。
作为国内互联网巨头的腾讯,相比间接投资,三年前选择直接成立AI制药平台,成为赛道上角逐玩家之一。
现在,腾讯AI制药平台成果进展如何?相比同赛道玩家,其竞争优势是否得以体现?
在MEET 2023大会上,腾讯医疗健康AIDD技术负责人刘伟,从腾讯制药AI算法实践的角度探讨了这一行业当前的现状。

为了完整体现刘伟的分享及思考,在不改变原意的基础上,量子位对他的演讲内容进行了编辑整理。
关于MEET智能未来大会:MEET大会是由量子位主办的智能科技领域顶级商业峰会,致力于探讨前沿科技技术的落地与行业应用。今年共有数十家主流媒体及直播平台报道直播了MEET2023大会,吸引了超过300万行业用户线上参会,全网总曝光量累积超过2000万。
演讲要点
-
在AlphaFold和AlphaFold2驱动下,AI药物行业发展速度非常快,而腾讯在蛋白质结构预测上的工作从2019年初就开始了。
-
骨架跃迁分子生成算法能在保证原有化合物活性的基础上,突破原有分子专利的保护,或者优化分子的ADMET性质。
-
只靠数据驱动的AI缺乏可解释性,要与领域知识相结合;药物AI是AI算法和领域知识相互发现,相互提升的过程。
-
AI辅助药物发现存在一个难题就是泛化性,即在A靶点中训练的AI模型,通常难以应用到B靶点上做预测。这个问题的解决对技术的突破至关重要。
(以下为刘伟演讲分享全文)
腾讯云深智药是一个怎样的平台?
我分享的题目为“腾讯制药AI算法实践”,会对腾讯过去3年积累的AI制药技术进行一个展示。
我叫刘伟,是腾讯AI药物发现这一块的技术负责人。今天我要讲的内容,主要包括三个部分:
第一部分是腾讯云深平台介绍,它实际上是沉淀了腾讯AI制药技术的一个平台;第二部分是平台的案例分享;第三部分总结平台的技术优势。
我们先介绍一下腾讯云深平台的两大功能模块,一个是小分子药物发现,另一个是大分子药物发现,这里主要指抗体药物发现。
其中,小分子模块包括蛋白质结构预测、分子生成等6个模块,大分子模块则由抗体结构预测、抗体亲和力、以及抗体人源化改造等几大模块组成。

时间有限,我们不会详细介绍每一个模块,主要会讲案例以及部分底层技术的实现。
腾讯云深平台四大案例分享
第一个案例是蛋白质结构预测,这块腾讯在国内可能是做得最早的。
最近在AlphaFold和AlphaFold2的驱动下,行业发展速度非常快,而腾讯从2019年初就开始做相关技术工作。
大家应该比较清楚,蛋白质是生命及其活动中非常重要的组成部分,蛋白质结构预测则是指给定一个氨基酸序列,来预测蛋白质的三维结构。
我们在2019年打造的一个预测pipeline,当时是基于分子动力学模拟和AI预测相结合的方法,构建了一个叫tFold的蛋白质结构预测平台。
在2020年比赛的时候,这个pipeline连续八周在评测平台排名第一。
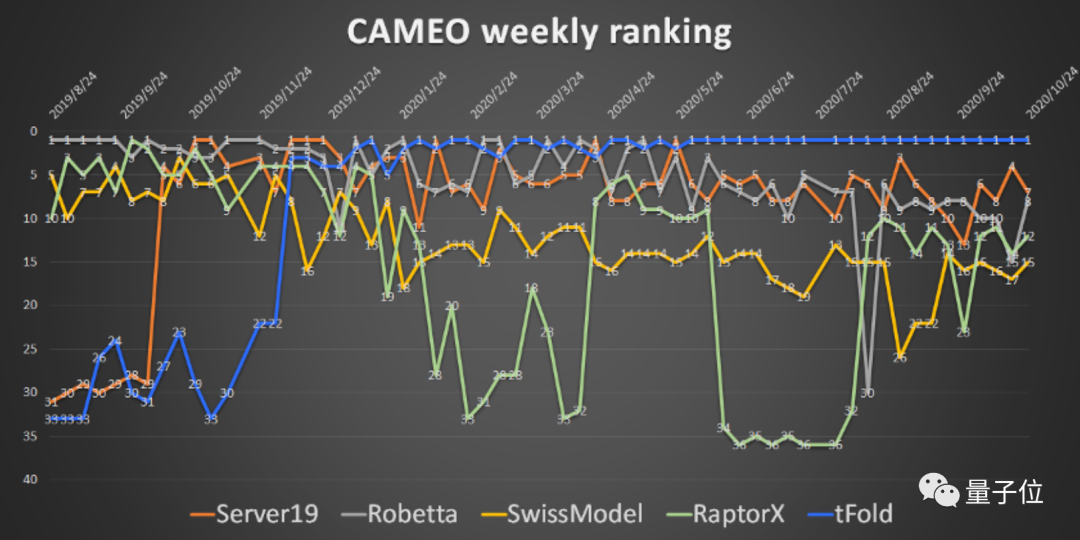
随后我们还参加了CASP竞赛,在国内获得了第一名,颜宁教授在她的论文中还引用了tFold平台,这是对我们在蛋白质结构预测上的成果的重要肯定。
第二个案例是结合物理学特征和本地数据训练,我们做了ADMET性质预测系列模型。
也是从2019年开始的工作,想跟大家分享两点:第一点是效果提升,以水溶性模块为例,我们做的ADMET相比头部商业软件效果平均会有20%的提升;第二点是ADMET预测成熟度,在与某药企合作上,我们会提供一个可以说是非常基础的模型,在药企拿到这样的模型之后,会基于具体项目的管线生成的很多内部数据,即项目和靶点相关的特定数据。
用这些数据对基础模型进行重新训练(retrain)、或者说做微调(finetune)后,它会有一个更好的提升。
比如我们与某个药企合作分析某系列化合物的心脏毒性,发现在项目中后期阶段,基本上与实验结果相关性达95%以上,后来药企就不太需要去做实验了,而是直接使用模型预测结果去做分析了。
所以我们在ADMET预测这块已经做到非常成熟,目前模型包含60多个属性预测模块,在腾讯云深平台上可以直接使用。
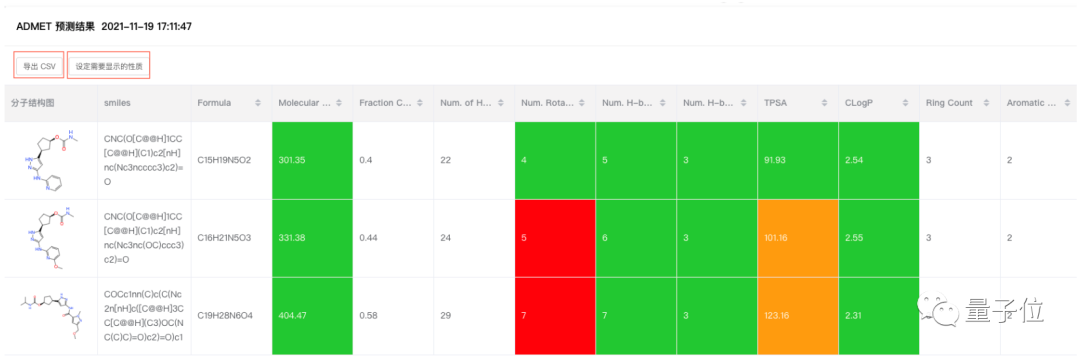
第三个案例是骨架跃迁分子生成算法,这也是针对国内药企或者国内科研机构的一些实际需求打造的,目前同样已经做得比较成熟。
通过骨架跃迁分子生成算法,就能在保证原有化合物活性的基础上,突破原有分子专利的保护,或者优化分子的ADMET性质。
我们自研了骨架跃迁算法,与药企做了一些合作,这些合作不仅帮助到药企发现了纳摩尔级别的多个化合物系列,也很好地验证了我们这个流程的健壮性,在不同的靶点、不同的复合物上都实现了比较好的效果,目前部分研究成果已经发表在期刊上。

第四个案例是将强化学习引入药物小分子的生成。
在生成分子的时候,我们不仅要考虑分子活性,还要考虑ADMET的属性,所以我们把这些流程做了一个打通,你可以定制这些ADMET属性的要求。
在生成过程当中,我们用上强化学习,使得生成出来的分子符合定制的属性要求,两个不同的模块能够相互提升和强化,最终建设一个非常完整的pipeline,这可以用在各种分子生成的场景中。
例如这个例子中,生成有两个要求,包括不能通过血脑屏障、以及logP的属性:
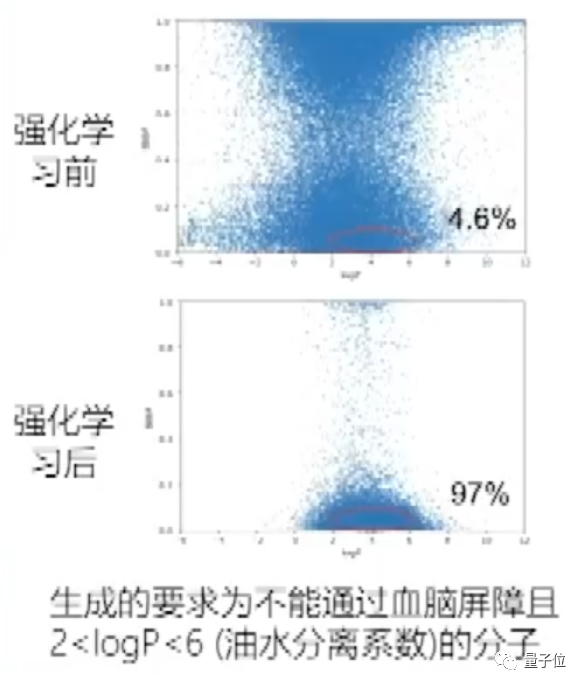
可以看到,在没有经过强化学习时,它的分布是比较弥散的,生成出来的化合物不太满足实际应用需求。但经过几轮强化迭代后,97%的分子都会满足生成的要求。



评论
沙发等你来抢